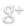INTRODUCCIÓN A LOS LÍQUIDOS
En los líquidos las moléculas están mas juntas. Apenas existe espacio entre las moléculas. Por lo tanto es mas difícil de comprimir un liquido que un gas. Así que los líquidos son mas densos que los gases.
Las moléculas se mantienen unidas por distintas fuerzas de atracción. Pueden moverse con libertad, por ello, un liquido puede fluir y derramarse. Un liquido puede tomar la forma del recipiente que lo contiene.
La conversión de un gas en un liquido o solido requiere que las moléculas se aproximen unas con otras. Esto se puede lograr aumentado la presión sobre el gas, o calentándolo.
Si tratamos de convertir un solido en un liquido o gas, se requiere un calentamiento o reducción de la presión. Ya que de esta forma las moléculas adoptarían un mayor movimiento.
Las transformaciones de un estado a otro se denominan cambios de fase. Estos cambios son transformaciones físicas que se distinguen por el cambio del orden molecular.
Una fase se define como porción de la materia con propiedades uniformes. O bien, porción de un sistema separado de los otros por limites físicos.
| Fuerzas | Distancias | Orden | Propiedades | |
| Gas | Despreciables frente a la agitación térmica | Largas y desiguales | Continuo movimiento al azar | Volumen variables, bajas densidades, fluidos, se difunden con rapidez |
| Liquido | Intermedias. Fuerzas de Van Der Waals | Cortas y desiguales | Semiorden | Volúmenes fijos, fluidos, altas densidades, se difunden a través de otros líquidos. |
| Solido | Grandes frente a la agitación térmica | Cortas e Iguales | Elevado orden | Volúmenes fijos, no son fluidos, tienen altas densidades, difunden lentamente. |
Las propiedades y características de los líquidos están determinadas por las fuerzas intermoleculares del mismo.
PROPIEDADES Y CARACTERÍSTICAS DE LOS LÍQUIDOS
Viscosidad
Es una medida de la resistencia de los líquidos a fluir. La fluidez de un liquido es mayor cuanto menor sea su viscosidad. La viscosidad aumenta con las fuerzas intermoleculares presentes en el liquido. Mientras mas viscoso sea, mas lento es su flujo.
La viscosidad disminuye al aumentar la temperatura, por lo tanto aumenta su fluidez.
Tensión superficial
Mide la energía necesaria para ampliar la superficie de un liquido.
Las moléculas que están en la superficie de un liquido están menos atraídas por las fuerzas intermoleculares respecto a las que se sitúan en el seno del mismo. Esto sucede porque no existe ninguna molécula arriba capaz de ejercer una fuerza intermolecular sobre las moléculas que se encuentran en la superficie.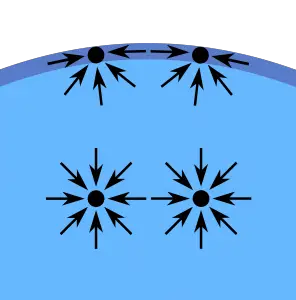
Acción Capilar
Las fuerzas de acción capilar se clasifican en dos.
Fuerzas de cohesión: Son las fuerzas que mantienen unidas a las moléculas de un liquido.
Fuerzas de Adhesión: Son las fuerzas de atracción entre un liquido y otra superficie.
La forma del menisco y la acción capilar del liquido producido por un liquido en un recipiente son causados por la diferencia entre las Fuerzas de cohesión y adhesión.
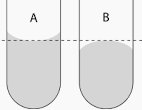
El agua y el vidrio son polares, por lo tanto las fuerzas de adhesión entre ambos son elevadas superando a las de cohesión del liquido. Por ello, el agua asciende por las paredes de un tubo de vidrio, aumentando así la superficie de contacto, como lo es en el caso de un menisco cóncavo ( Figura A).
Si el liquido utilizado es mercurio, las fuerzas de cohesión son mayores que las de adhesión, por lo cual el menisco que se forma es convexo (Figura B).
La acción capilar se puede apreciar cuando el tubo es de muy pequeño diámetro. Si las fuerzas de Cohesión son mayores que las de Adhesión, el liquido continua ascendiendo hasta que se logre el equilibrio entre las fuerzas de adhesión y el peso de liquido.