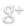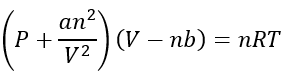Los gases que se desvían del comportamiento ideal son conocidos como gases reales, no cumplen con la ecuación de estado de los gases reales.. Se originan en dos factores:
- La teoría dice que a medida que aumenta la presión el volumen del gas se vuelve mas pequeño y se acerca a cero. Aunque se acerca a un número pequeño, no será cero porque las moléculas ocupan espacio (es decir, tienen volumen) y no pueden ser comprimidas.
- Existen fuerzas intermoleculares en los gases. Estas fuerzas se vuelven cada vez mas importantes en temperaturas bajas, donde el movimiento traslacional de las moléculas disminuye, casi hasta detenerse. Sin embargo, a altas temperaturas, o incluso a temperaturas normales, las fuerzas intermoleculares son muy pequeñas y tienden a considerarse insignificantes.
Introducción
Mientras que la Teoría Cinética-Molecular hace un excelente trabajo explicando los gases, hay algunas propiedades que no explica con respecto a su descripción de los gases reales. La teoría asume que las colisiones entre moléculas de gas y las paredes de un contenedor son perfectamente elásticas, las partículas de gas no tienen ningún volumen y no hay fuerzas de repulsión o de atracción entre moléculas. Estas suposiciones se refieren a los gases ideales. Si bien estas suposiciones generalmente son ciertas, existen circunstancias en las que los gases se desvían del comportamiento ideal.
Los gases tienden a comportarse idealmente en dos situaciones diferentes:
- Se comportan idealmente a altas temperaturas: Esto se debe al hecho de que las moléculas vuelan unas sobre otras a velocidades extremadamente altas (debemos recordar que la temperatura es una medida de la energía cinética media, que es directamente proporcional a la velocidad).
- Se comportan idealmente a presiones bajas: Esto se debe a que a bajas presiones, el volumen de las moléculas tiende a ser insignificante en comparación con el volumen total del gas (recordar que la Ley de Boyle dice que la presión y el volumen son inversamente proporcionales).
¿cuándo se comportan de manera no ideal?
Los gases se comportan de manera no ideal (o real) a temperaturas frías debido al hecho de que a temperaturas frías, las moléculas se mueven lentamente, permitiendo que las fuerzas de repulsión o de atracción surtan efecto, desviándose del comportamiento de un gas ideal. Los gases también se comportan de forma no ideal a altas presiones, porque a altas presiones, el volumen de moléculas se convierte en un factor.
Gases reales y volumen molar
Para ilustrar las pequeñas diferencias entre las propiedades numéricas de los gases reales e ideales a temperaturas y presiones normales, considere la siguiente comparación. Recordará que usamos la ecuación de gas ideal para calcular un valor para el volumen molar de un gas ideal en condiciones normales de presión y temperatura.
Si se conoce la densidad de un gas a una temperatura y presión determinada, calcular su volumen molar será relativamente fácil. Por ejemplo: Con una presión 1 atm a 273 K, la densidad del helio es de 0,1785 g/L . Esto significa que 0,1785 g de helio ocupa 1 Litro en condiciones normales de presión y temperatura (1 atmósfera y 273 K). Entonces para calcular el volumen molar, por ejemplo del Helio:
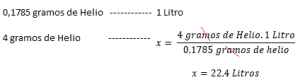
| Densidades de los gases y Volumen Molar (a condiciones normales de presión y temperatura) | ||
| Densidad (g/L) | Volumen Molar (Litros) | |
| He | 0.1785 | 22.4 |
| N2 | 1.2506 | 22.4 |
| O2 | 1.4290 | 22.4 |
| CH4 | 0.717 | 22.3 |
| CO2 | 1.977 | 22.3 |
| C2H4 | 1.260 | 22.2 |
| NH3 | 0.769 | 22.1 |
| SO2 | 2.926 | 21.9 |
Aunque para los cálculos sencillos usamos el valor 22,4 Litros para todos los gases, se puede ver que no es exactamente cierto. Incluso a temperaturas y presiones normales, los gases reales pueden desviarse ligeramente del comportamiento ideal. La desviación es mucho mayor en condiciones más extremas, como veremos a continuación:
Factores de compresión
Para un gas ideal, PV=nRT. Se cumple que al dividir PV/nRT = 1 .
Para los gases reales esto solo es posible a presiones bajas (menores a 5 atmosferas). Analizando la grafica se observa que la desviacion se hace mas pronuncioada con el aumento de la presion. Y aumentando la temperatura el gas toma un comportamiento cercano al ideal.
En un gas real, a medida que aumenta la presión, el cociente entre PV/nRT aumenta a un número mayor que uno, (PV/nRT > 1) distorsionando la idealidad. Lo mismo ocurre cuando una temperatura disminuye, ya que el factor de compresibilidad vuelve a aumentar por encima de 1 (PV/nRT > 1) a medida que la temperatura se acerca a un número menor.
Un gas ideal tiene un factor de compresibilidad igual a uno, pero el factor de compresibilidad para un gas real puede variar enormemente de este número. Los gráficos de abajo muestran cómo varía esto para el nitrógeno a medida que usted cambia la temperatura y la presión.
Si el nitrógeno fuera un gas ideal en todas las condiciones de temperatura y presión, cada una de estas curvas sería una línea recta horizontal que mostraría un factor de compresión de 1. (Claro que esto no es verdad obviamente).
A tener en cuenta
A presiones bajas de aproximadamente un poco menos de 1 atmósfera, el factor de compresión se aproxima a 1. El nitrógeno se aproxima al comportamiento ideal a presiones ordinarias.
El comportamiento no ideal empeora a temperaturas más bajas. Para temperaturas de 300 o 400 K, el factor de compresión se aproxima a 1 en un amplio rango de presiones. El nitrógeno se vuelve más ideal en un rango de presión mayor a medida que aumenta la temperatura.
El comportamiento no ideal empeora a presiones más altas.
Debe haber al menos un efecto que haga que la relación PV / nRT sea demasiado baja, especialmente a bajas temperaturas. Y debe haber al menos un efecto que haga que aumente demasiado a medida que aumenta la presión.
¿Se manifiesta el mismo comportamiento con otros gases?
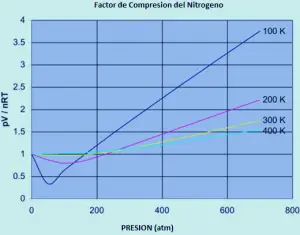
El siguiente gráfico se muestra cómo los factores de compresión varían con la presión para una variedad de gases a una temperatura fija de 273K.
Si usted tuviera que rehacer el conjunto de las gráficas originales de nitrógeno (a temperaturas variables) para cualquiera de estos otros gases, encontraría que cada uno de ellos producirá un conjunto de curvas similares a las del nitrógeno. Lo que varía es la temperatura a la que se producen las diferentes formas gráficas. Por ejemplo, si se observa la gráfica de dióxido de carbono a 273 K (Grafico anterior), se ve similar a la de nitrógeno a 100 K del primer conjunto de curvas, aunque no aumenta tan pronunciadamente a presiones más altas.
Es fácil decir que los gases se vuelven menos ideales a bajas temperaturas, pero lo que cuenta como baja temperatura varía de un gas a otro. Cuanto más cerca de la temperatura a la que el gas se convierte en líquido (o, en el caso del dióxido de carbono, en un sólido), más no ideal se vuelve el gas.
¿Qué causa el comportamiento no ideal?
En las suposiciones que hacemos sobre los gases ideales, hay dos afirmaciones que dicen cosas que no pueden ser verdaderas de un gas real, y éstas tienen un efecto tanto en la presión como en el volumen.
El problema del volumen:
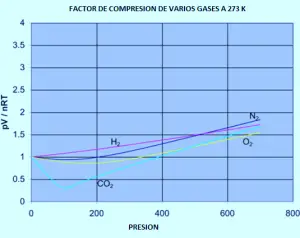
La teoría cinética supone que, para un gas ideal, el volumen ocupado por las propias moléculas es totalmente insignificante en comparación con el volumen del recipiente. Para un gas de verdad (real), esa suposición no es cierta. Las propias moléculas ocupan una parte del espacio en el contenedor. El espacio en el contenedor disponible para que las cosas se muevan es menor que el volumen medido del contenedor.
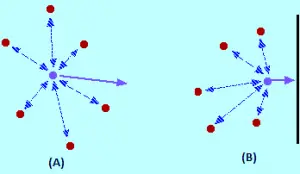
En la imagen (A) la teoría cinética asume que todo este espacio está disponible para que las moléculas se muevan dentro. Pero en realidad como se ve en la imagen (B), sólo esa cantidad de espacio está disponible, porque el resto del volumen es ocupado por las propias moleculas.
Si la presión es baja, el volumen ocupado por las moléculas reales es insignificante en comparación con el volumen total del recipiente. Pero a medida que el gas se comprime, la proporción del volumen total que las propias moléculas ocupan aumenta cada vez más. Imagina que estás comprimiendo tanto el gas que las moléculas se tocan entre sí. En ese punto el volumen disponible para que las moléculas se muevan es cero.
Supongamos que a una presión elevada el volumen del recipiente es 1000 cm3 , pero suponiendo que las moléculas ocupen hasta 100 cm3 de él.
La ecuación de gas ideal se elaboró haciendo cálculos basados en las hipótesis de las teóricas cinéticas. Se supone que V en PV es el volumen disponible para que las moleculas puedan moverse libremente, pero en este caso sólo sería de 900 cm3, no de 1000 cm3.
Si calculamos el factor de compresion, PV / nRT , poniendo el volumen total del contenedor en la formula, el valor que obtendremos como resultado sera mas alta de lo que deberia ser ( ya que el verdadero volumen deberia ser 900 cm3).
Para un gas real como el nitrógeno, observe cómo el factor de compresión tiende a aumentar con la presión, mientras que para un gas ideal, el factor de compresión sería de 1 a cualquier valor de presion.
El valor del factor de compresión es demasiado alto a altas presiones para un gas real. La razón de esto es que el volumen medido que utilizamos en la expresión PV / nRT es demasiado alto (recordemos el caso anterior) y no tomamos en cuenta el volumen ocupado por las moléculas. Ese error se nota mas cuando el gas se comprime.
El problema de la presión:
Otra hipótesis de la Teoría Cinética para los gases ideales es que no hay fuerzas intermoleculares entre las moléculas. Eso está mal, ya que en los gases reales esto no es así. Si no hubiera fuerzas intermoleculares sería imposible condensar el gas como líquido. Incluso el helio, que posee la menor de todas las fuerzas intermoleculares, puede convertirse en un líquido si la temperatura es lo suficientemente baja.
¿Qué efecto tienen las fuerzas intermoleculares? Para una molécula de gas que se encuentra en el centro del recipiente, no habrá un efecto no ( Imagen A). Las moléculas se atraerán hasta un punto donde esas atracciones se anularan mutuamente. Las atracciones ejercida por la molécula de atrás, tienden a ralentizar, y serán canceladas por las atracciones de las moléculas delante de ella, tendiendo a acelerarla (ambas atracciones se cancelan).
La molécula continuara moviéndose en la misma dirección a la misma velocidad, pero cuando esta por golpear el contenedor ocurre lo siguiente: Al no haber moléculas delante de él, ya no se produce el cancelamiento de las atracciones intermoleculares. Por lo tanto, la molécula comienza a disminuir su velocidad justo antes de golpear con la pared del recipiente (Imagen B). En consecuencia chocará con la pared con menos fuerza y menos presión.
El efecto general de esto es la culpable que la presión sea menor de lo que sería si el gas fuera ideal. Esto significa que si se coloca la presión medida en la expresión PV / nRT, el valor del factor de compresión será menor que si el gas fuera ideal. Esta es la razón por la que, en algunas condiciones, los gráficos de los factores de compresión están por debajo del valor ideal de 1. Veamos otra vez el ejemplo del Nitrógeno (Si ya lo se, te cansaste de la grafica jaja).
Este efecto es más importante a bajas temperaturas. ¿Por qué? A temperaturas bajas, las moléculas se mueven más lentamente. A temperaturas más altas, donde las moléculas se mueven mucho más rápido, cualquier pequeño retroceso de la molécula hacia el centro del gas apenas se notará. A altas temperaturas, el efecto de las fuerzas intermoleculares es ciertamente insignificante ya que las moléculas escapan de las interacciones.
Y hay un efecto final en cuanto a las fuerzas intermoleculares, que está ligeramente más oculto. A medida que aumenta la presión, las moléculas se encuentran mas juntas. Si están más cerca, las fuerzas intermoleculares serán más importantes.
¿Cuál es el gas más ideal?
Deberíamos buscar un gas cuyas moléculas sean las más pequeñas posibles, y donde las fuerzas intermoleculares sean muy bajas. Ese gas sería el helio. Una molécula de helio tiene en un solo átomo que es muy pequeño, y las fuerzas de dispersión Van der Waals son muy bajas.
Al igual que el helio, una molécula de hidrógeno también tiene dos electrones, por lo que las fuerzas intermoleculares van a ser pequeñas (pero no tan pequeñas como el helio). En la molécula de hidrógeno, usted tiene dos átomos sobre los que puede distribuir las cargas. A medida que las moléculas se hacen más grandes, entonces las fuerzas de dispersión aumentarán, y usted puede obtener otras fuerzas intermoleculares como por ejemplo atracciones dipolo-dipolo. Los gases hechos de moléculas como estas serán mucho menos ideales.
La ecuación van der Waals
Hay un gran número de ecuaciones que pueden describir cómo actúan los gases reales, pero para hacerlo simple, los químicos se adhieren a la ecuación Van der Waals porque es la más fácil de describir cómo actúan los gases:
P es la presión en atmósferas (atm)
V es el volumen en litros (L)
n es el número de moles(mol)
a es solo una constante de proporcionalidad
b también es una constante de proporcionalidad
Ten en cuenta que es muy similar a la ecuación de gas ideal, pero corrige algunas cosas.
El lado derecho de la ecuación es exactamente el mismo que la ecuación de gas ideal. Sólo cambia con respecto a la presión y el volumen para dar cuenta de las cosas con respecto a las fuerzas intermoleculares y el volumen de moléculas de gas.
En el lado izquierdo explica una menor presión que el de un gas ideal, ya que tiene en cuenta las correcciones que ocurren cuando las moléculas suavizan el impacto de las demás moléculas a partir de las interacciones intermoleculares.