Símbolos de Lewis
Para empezar con estructura de lewis, es importante comprender estos símbolos que son una representación gráfica de la ubicación de los electrones en un átomo. Se colocan los electrones de valencia como puntos alrededor del símbolo del elemento.
Regla del Octeto
Los átomos se unen compartiendo electrones hasta completar la última capa con 8 electrones (4 pares) con lo que alcanzan la configuración de gas noble: ns2np6. Esto se conoce como la regla del octeto.
Estructuras de Lewis o de electrón-punto
La forma más sencilla de simbolizar la estructura electrónica y el enlace en una molécula es mediante estructuras de Lewis. En estas estructuras, cada electrón de valencia se representa mediante un punto, o cada par de electrones mediante una línea.
| ELEMENTO | CONFIGURACIÓN ELECTRÓNICA | SÍMBOLO DE LEWIS |
| Li | [He] 2s1 | |
| Be | [He] 2s2 | |
| B | [He] 2s2 2p1 | |
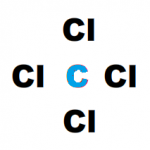
| C | [He] 2s2 2p2 | |
| N | [He] 2s2 2p3 | |
| O | [He] 2s2 2p4 | |
| F | [He] 2s2 2p5 | |
| Ne | [He] 2s2 2p6 |
Para dibujar lo que es la estructura de Lewis
- Se dibuja el esqueleto molecular colocando los símbolos de los elementos. En general el átomo menos electronegativo ocupa la posición central.
- Se colocan los electrones de valencia del átomo central alrededor del mismo.
- Se distribuyen los electrones de los átomos que rodean al átomo central, teniendo en cuenta la regla del octeto. Los átomos individuales se combinan tendiendo a tener completa la última capa de electrones. Es decir a adquirir la configuración electrónica del gas noble más próximo.
- Para conseguir que se cumpla la regla del octeto en algunos casos puede ser necesario utilizar enlaces múltiples. Por ejemplo para la molecula de dioxido de carbono CO2 su estructura de Lewis es la siguiente.
Los pares de electrones pueden ser:
- Compartidos entre dos átomos, formando enlaces simples, dobles o triples. Cada par de electrones entre dos equivale a un enlace.
- No compartidos (o pares solitarios, o no enlazantes). Los átomos de oxigeno, nitrogeno y los halógenos tienen normalmente electrones no enlazantes en sus compuestos estables. Estos pares libres tienen importancia en la reactividad de las moléculas.
Por ejemplo en la molécula de CO2 hay dos pares de electrones compartidos entre el C y cada O, y cuatro pares no compartidos o no enlazantes.
Estructura de Lewis de los oxiácidos
En la estructura de los oxoácidos, se coloca un grupo oxhidrilo por cada hidrógeno reemplazable que posea el ácido. Por ejemplo, el H3PO4 (Ácido fosfórico) tiene 3 hidrógenos reemplazables y por lo tanto 3 grupos OH.
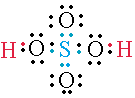
En el H2SO4 (Ácido sulfúrico) hay dos hidrógenos reemplazables. En consecuencia tendrá 2 grupos OH.
Enlace dativo covalente coordinado
En este tipo de enlace solo uno de los átomos proporciona el par de electrones de enlace. En el ejemplo del ácido sulfúrico podemos observar enlaces formados por un par de electrones proporcionados por el átomo de azufre.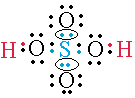
Estructura de Lewis de sustancias Iónicas
El enlace iónico se produce cuando los elementos son de muy diferente electronegatividad. Por ejemplo: el cloro y el sodio cuyos respectivos simbolos de Lewis son:
El cloruro de sodio, está formado por los iones de carga opuesta Cl– y Na+, y la formula de Lewis correspondiente es:
También son sustancias iónicas las formadas por un catión metálico y un radical negativo como los iones SO4 3- , PO4 3-, etc.
Para escribir el modelo de Lewis de un anion o radical, se suprimen de la formula del acido los H de los grupos OH, y se colocan tantas cargas negativas como H hayan sido suprimidos. Por ejemplo para el ion sulfato, el radical tiene dos cargas negativas. (Los puntos rojos indican los electrones de valencia del Hidrógeno que quedaron con el oxígeno, por eso la carga -2).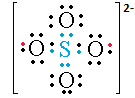
En la estructuras de Lewis de las especies iónicas, el total de las cargas negativas debe ser igual al total de las cargas positivas.
La notacion de Lewis del sulfato de aluminio seria:
Fórmulas desarrolladas (de trazos o rayas)
En algunos casos puede expresarse una molécula mediante estructuras de trazos o rayas. Cada raya representa un par de electrones. Pueden representarse todos los electrones: pares de enlace y pares no enlazantes, o solo los pares enlazantes.
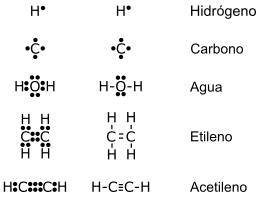
Estructura de Lewis Ejemplos
Carga Formal (CF)
En algunas estructuras de Lewis alguno de los elementos puede poseer cargas formales que no necesariamente corresponden a cargas reales. Las cargas formales ayudan a saber qué átomos poseen mayor carga y, también, que atomos estan cargados en una molécula neutra.
Reglas para decidir si una estructura de Lewis es aceptable:
- La suma de las cargas formales debe ser cero para una molécula neutra e igual al a carga para un ion.
- De ser necesarias las cargas formales, estas deben ser lo menores posibles.
- Las Cargas formales suelen aparecer sobre los átomos más electronegativos y las positivas sobre los átomos menos electronegativos.
- Las estructuras con cargas del mismo signo en átomos adyacente son poco probables.
La carga formal es la diferencia entre el número de electrones de valencia y el número de electrones asignados en la estructura de Lewis (que son los electrones no compartidos y la mitad de los electrones compartidos).
CF = N° e– de valencia – N° e– no compartidos – ½ N° e– no compartidos
Por ejemplo para cada átomo de O en CO2:
CF = 6 – 4 – 2 = 0
La estructura de Lewis mas probable es aquella para la cual:
- El valor de la CF sea más próximo a cero.
- Si existe CF, la CF negativa esté localizada sobre el átomo más electronegativo.
La carga formal de una molécula es la suma algebraica de las cargas formales de los átomos que la constituyen, en consecuencia, una molécula puede ser neutra aunque los átomos que la componen no lo sean.
Estructura de Lewis Ejercicios:
Dibujar la representacion de Lewis para cada uno de los siguientes compuestos.
O2 , CO2 , CO , NO2 , NO, H2O , H2SO4 , H3PO4 , NO3– , K2SO4 , Cloro Molecular, H2O2.
Lista de Ejemplos de Estructura de Lewis:
- CO2 (Dióxido de Carbono).
- O2 (Oxigeno Molecular ).
- H2O (Agua).
- H2SO4 (Ácido Sulfúrico).
- CO (Monóxido de Carbono).






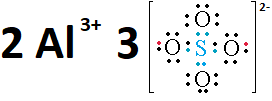
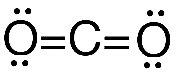
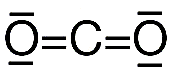
Es buena la informacion 😉😉😉😉😉
hola, entendi todo perfectamente, podrias explicar sobre la configuracion electronica?
Muchas gracias