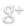¿Como hacer la Estructura de Lewis del SO3 (Trióxido de azufre) paso a paso?
Para realizar la Estructura de Lewis del SO3 (Trióxido de Azufre) seguiremos las siguientes recomendaciones.
Comience por dibujar la estructura de la de la molécula utilizando únicamente enlaces simples, ignorando los posibles enlaces dobles y triples:
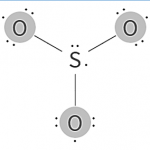
El siguiente paso será contar los electrones de valencia de cada átomo y sumarlos:
| ÁTOMO | VALENCIA |
| Azufre (S) | 6 |
| Oxígeno (O) | 6 |
Como el diagrama de Lewis del SO3 posee tres oxígenos, multiplicaremos su valencia por tres.
De este modo la valencia total sería la siguiente:
3 O Valencia + S Valencia = 3 x 6 + 6 = 24
El próximo paso será el de calcular el número de electrones necesarios para llenar la última capa de valencia, osea el orbital más externo.
Para llenar completamente el último orbital el oxígeno requiere 8 electrones, pero como son tres átomos de oxígeno lo multiplicaremos por 3.
El Azufre por su parte únicamente necesitará 8 electrones para completar su último orbital.
3 O ultima capa + S ultima capa = 3 x 8 + 8 = 32
Ahora restaremos ambos valores 32 – 24 = 8 , el resultado serán 8 electrones enlazantes.
Cada enlace tiene dos electrones, así que además de los 3 enlaces ya presentes en el diagrama, esperamos añadir 1 enlace.
Para minimizar la carga formal, el oxígeno necesitará 2 enlaces. En la imagen se encuentran remarcados los átomos de oxígeno que necesitan enlaces adicionales y el número de electrones restantes en cada átomo:
Añadimos 1 enlace emparejando electrones entre los átomos adyacentes resaltados.
El Azufre puede expandir su octeto y formar 6 enlaces, esto es debido a que la electronegatividad del azufre es menor que la electronegatividad del oxígeno.