El equilibrio químico es un estado en el que no se observan cambios a medida que transcurre el tiempo. Es decir que se caracteriza porque sus propiedades macroscópicas no varían con el tiempo.
REACCIONES QUÍMICAS
Para que sea posible una reacción química, es necesaria la presencia de compuestos químicos reaccionantes que daran origen a dos o más compuestos químicos resultantes denominados productos de la reacción.
a A + b B ⇒ c C + d D
Estas reacciones pueden ser irreversibles o reversibles.
Reacciones químicas irreversibles
se producen cuando uno o más compuestos químicos reaccionantes se agotan y no es posible volver a obtener las sustancias originales, es una reacción que transcurre en un solo sentido. Se expresa con el símbolo ⇒. Por ejemplo:
Mg + 2 HCl ⇒ MgCl2 + H2
Reacciones químicas reversibles
Son aquellas en las que los reaccionantes dan lugar a productos (reacción directa) y que a su vez los productos reaccionan entre si generando de nuevo los reactivos (reacción inversa). La reacción transcurre en ambos sentidos y se expresa con el símbolo ↔. Por ejemplo:
PCl3 (g) + Cl2 (g) ↔ PCl5 (g)
Las reacciones reversibles pueden conducir a un estado de equilibrio químico.
¿Cómo se llega al equilibrio químico?
Teniendo en cuenta la siguiente ecuacion: A + B ↔ C + D , representa una reacción quimica en equilibrio quimico.
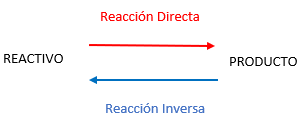
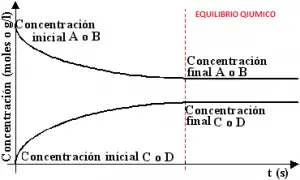
Al comienzo de la reacción (en un tiempo = 0) tanto el reactivo A como el reactivo B se encuentran en su máxima concentración. A medida que transcurre la reacción, las concentraciones de ambos reactivos disminuyen mientras aumentan las concentraciones de los productos C y D.
En las imágenes se puede observar como la reacción alcanza un punto en el cual no es posible detectar cambios netos de concentración, las concentraciones de A y B, C y D se estabilizan en valores especificos y no varian con el tiempo. A partir de tal instante “sucede como si la reacción estuviera detenida”, pero la reacción se sigue produciendo, solo que las proporciones de reactivos y productos se mantienen constantes. Se dice entonces que se alcanzo el equilibrio quimico.
Cada proceso posee una velocidad propia que va variando con el tiempo. En los comienzos la velocidad de la reacción directa (Vd) es mucho mayor que la de la reacción inversa (Vi), debido a la diferencia de concentraciones entre reactivos y productos; pero a medida que los productos se van formando, los reactivos van desapareciendo con lo cual ambas velocidades se aproximan hasta hacerse iguales, Vd = Vi (La velocidad de la reacción directa es igual a la velocidad de la reacción inversa).
Características del equilibrio químico
- Cuando se alcanza el equilibrio químico las moléculas de los reactivos y productos se combinan y descomponen continuamente dando lugar a un equilibrio dinámico.
- Las velocidades de reacción directa (→) e inversa (←) son iguales.
- Las concentraciones de reactivos y productos permanecen constantes.
- Se puede observar alguna propiedad que permanezca constante con el tiempo, por ejemplo el color, densidad, pH, etc.
- Para que se alcance el equilibrio se necesita que la reacción se desarrolle en un sistema cerrado donde la temperatura, presión y concentración sea constante y en el que ninguna sustancia pueda entrar o salir del sistema. Si alguno de los productos o reactivos abandona el sistema se rompería el equilibrio y la reacción se desplazará hacia un solo sentido hasta que se vuelva a alcanzar el equilibrio.
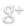


excelente