La velocidad de reacción, VR, es una magnitud que expresa el cambio de concentración de un reactivo o producto con el tiempo.
Por ejemplo la conversión del carbono grafito en carbono diamante ocurre en miles de años, la oxidación del hierro bajo condiciones atmosféricas puede tomar varios años, mientras que la combustión del metano (presente en el gas natural) es una reacción inmediata.
Para conocer la magnitud de la velocidad de reacción VR necesitamos medir la cantidad de un reactivo que desaparece por unidad de tiempo, o bien, la cantidad de un producto formado por unidad de tiempo.
La unidad de la velocidad de reacción se expresa en unidades de concentración respecto al tiempo, por ejemplo: mol/L. seg, , o si es un gas se mide en unidades de presión respecto al tiempo, atm/seg.
A modo de ejemplo supongamos una reacción tipo: A → B + C
Mientras el reactivo A se consume para formar los productos su concentración disminuye. Simultáneamente, los productos se van formando y aumentan sus concentraciones. Tales cambios se expresan matemáticamente como:
El signo negativo que aparece en la ecuación anterior representa la DISMINUCIÓN de la concentración del reactivo A, mientras que los cambios de concentración de los reactivos B y C van en AUMENTO.
Estos cambios de concentración respecto al tiempo hacen referencia a la velocidad media de la reacción, debido a que no todas las moléculas necesitan los mismos tiempos para reaccionar.
A medida que transcurre el tiempo los cambios de concentración de A son menores, de modo que la velocidad también disminuye.
En la siguiente gráfica se puede apreciar la disminución de la concentración del reactivo A y el aumento de la concentración del reactivo B, que se forma a expensas de la disminución de [A].
Hay que tener en cuenta que la velocidad de la reacción también depende de los coeficientes estequiométricos de las especies involucradas.
Para una reacción del tipo: 2A → C + 3B.
Según la estequiometría, por cada 2 moles de A que se descomponen, se forman 1 mol de C y 3 moles de B.
La velocidad de formación de C es 1/3 de la velocidad de formación de B y también resulta 1/2 de la velocidad de reacción de A. Por lo tanto, la velocidad de reacción VR se expresa:![]()
Es conveniente expresar la ecuación anterior en términos de diferenciales, para obtener una expresión matemática y valores más acotados. La ecuación anterior nos quedaría:![]()
A modo de resumen, para una reacción química hipotética del tipo: a A + b B → c C + d D
Las letras minúsculas (a, b, c ,d) representan los coeficientes estequiométricos, mientras que las letras mayúsculas representan a los reactivos (A y B) y los productos (C y D).
NOTA: Estas ecuaciones tienen validez siempre que se trate de una sola reacción que ocurre en un sistema cerrado y a volumen constante, donde las condiciones deben ser explicitadas, de lo contrario la expresión es incorrecta.
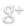


muchas gracias. me sirvio